Основные химические реакции – это основа для понимания принципов взаимодействия кислот и оснований. Все кислоты и основания, как сильные, так и слабые, обладают способностью давать ионные реакции. Однако, сильные основания и слабые кислоты имеют определенные отличительные черты, которые стоит рассмотреть подробнее.
Сильные основания – это химические соединения, которые полностью диссоциируются в водном растворе, образуя ионные реакции и отдавая все свои гидроксильные ионы. В результате этого процесса образуется стабильное растворение гидроксильных ионов. Например, щелочи – типичные сильные основания, такие как NaOH (натрия гидроксид), Ca(OH)2 (кальция гидроксид) и KOH (калия гидроксид), полностью диссоциируются в воде, образуя соответствующие металлические ионы и гидроксильные ионы.
С другой стороны, слабые кислоты – это химические соединения, которые не полностью диссоциируются в воде, а лишь частично. Это означает, что только небольшая часть молекул слабой кислоты превращается в ионы водорода. Примеры слабых кислот включают уксусную кислоту (CH3COOH) и угольную кислоту (H2CO3). Таким образом, их реакции более медленны и не так интенсивны, как у сильных кислот.
Взаимодействие между сильным основанием и слабой кислотой – это один из классических примеров кислотно-основного взаимодействия. Когда слабая кислота вступает в реакцию с сильным основанием, происходит нейтрализационная реакция, при которой сильное основание отдает свои гидроксильные ионы, а слабая кислота принимает их.
Основание и кислота: взаимодействие и различия

Сильное основание характеризуется высокой активностью и способностью образовывать ион OH-. Примером сильного основания является натриевая гидроксидная щелочь NaOH. Она полностью диссоциирует в растворе, образуя ионы Na+ и OH-. Слабое основание, например, аммиак NH3, образует меньшее количество ионов OH- в растворе.
Слабые кислоты, в отличие от сильных кислот, не полностью диссоциируют в воде и образуют меньшее количество ионов водорода H+. Например, уксусная кислота CH3COOH - слабая кислота, которая образует лишь небольшое количество ионов H+ в растворе. Сильная кислота, например, серная H2SO4, полностью диссоциирует и образует большое количество ионов H+.
Взаимодействие основания и кислоты приводит к образованию соли и воды. При этом ионы OH- основания объединяются с ионами H+ кислоты, образуя молекулу воды. Оставшиеся ионы образуют соль, которая может быть растворимой или нерастворимой.
Таким образом, сильное основание полностью реагирует с кислотой, образуя воду и растворимую соль. Слабое основание может реагировать лишь частично, образуя меньшее количество воды и растворимой соли.
Важно отметить, что кислота и основание могут взаимодействовать не только водным растворе, но и в твердом состоянии. В этом случае образуется соль с кислотным или основным катионом и анионом.
Сильное основание: свойства и примеры
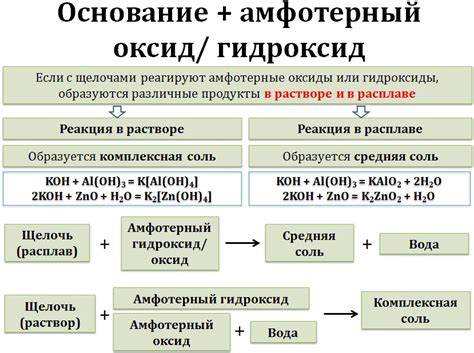
Основанием называется вещество, способное отдавать один или несколько ОН-ионов (или протонов) в раствор. Сильными основаниями называют такие вещества, которые полностью диссоциируют в воде, образуя гидроксидные ионы.
Свойства сильных оснований:
- Полное диссоциирование в воде, что означает, что все молекулы сильного основания распадаются на ионы.
- Высокая проводимость электрического тока в водном растворе.
- Образование гидроксидных ионов (OH-) в результате диссоциации.
- Алкальный раствор (реакция образования OH- ионов).
Примеры сильных оснований:
- Натриевая гидроксидная щелочь (NaOH) - это одно из наиболее распространенных и сильных оснований. Используется в качестве реагента при производстве веществ и бытовых нужд.
- Калиевая гидроксидная щелочь (KOH) - аналогично натриевой гидроксидной щелочи, широко используется в промышленности.
- Гидроксид кальция (Ca(OH)2) - широко используется в строительной отрасли, а также в сельском хозяйстве для улучшения почвы.
- Аммиак (NH3) - не только является сильным основанием, но также и одним из самых распространенных. Часто используется в бытовой химии.
Слабая кислота: свойства и примеры
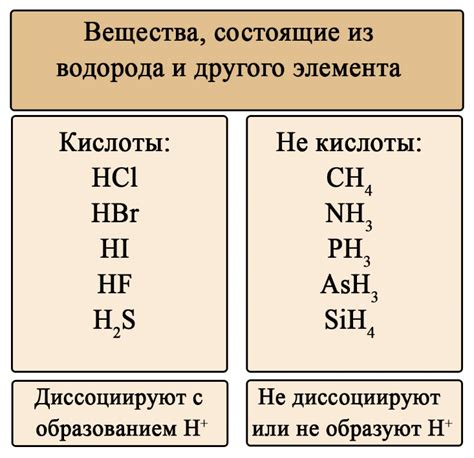
Свойства слабых кислот напрямую связаны с их молекулярной структурой и химическим составом. Одним из основных свойств слабых кислот является их относительная нейтральность по сравнению с сильными кислотами. Слабые кислоты не проявляют выраженной коррозионной активности и могут быть более безопасными для использования.
Примерами слабых кислот являются органические кислоты, такие как уксусная кислота (CH3COOH), молочная кислота (C3H6O3), аскорбиновая кислота (C6H8O6) и многочисленные другие. Они широко применяются в различных сферах, включая пищевую промышленность, фармацевтику, косметику и многие другие.
Реакция сильного основания с слабой кислотой
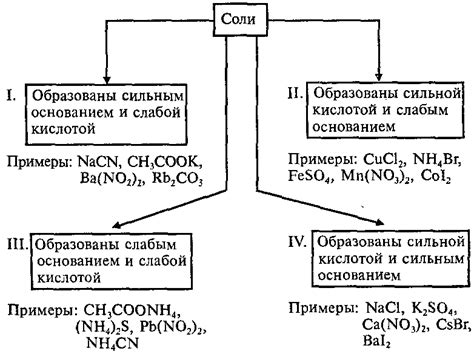
Сильное основание обладает высокой основностью и способно отдавать OH- ионы, такие как NaOH (гидроксид натрия) или KOH (гидроксид калия). Слабая кислота, в свою очередь, отдает H+ ионы в растворе, например, такие как уксусная кислота (CH3COOH) или угольная кислота (H2CO3).
| Сильное основание | Слабая кислота | Продукты реакции |
|---|---|---|
| NaOH | CH3COOH | CH3COONa + H2O |
| KOH | H2CO3 | K2CO3 + H2O |
При реакции сильного основания со слабой кислотой, сначала ионы OH- от основания соединяются с ионами H+ от кислоты, образуя молекулы воды (H2O). Затем образовавшиеся ионы соли (Na+ и CH3COO-; K+ и CO3^2-) остаются в растворе.
Реакция между сильными основаниями и слабыми кислотами происходит до полной нейтрализации инициальных реагентов. В результате образуются мягкие и химически стабильные соединения - соли, которые могут быть использованы в различных областях, включая пищевую промышленность и медицину.
Реакция слабого основания с сильной кислотой

Когда в растворе смешивают слабое основание и сильную кислоту, происходит их нейтрализационная реакция. Сильная кислота отдает свой протон (H+) слабому основанию, которое принимает его, образуя слабую соль. Например, при реакции серной кислоты (H2SO4) и аммиака (NH3) образуется сульфат аммония (NH4)2SO4:
H2SO4 + 2NH3 = (NH4)2SO4
В результате такой реакции образуется слабая соль, которая может полностью диссоциировать или частично оставаться недиссоциированной, в зависимости от степени диссоциации слабого основания. При этом pH раствора может значительно изменяться, в зависимости от концентраций и свойств веществ, участвующих в реакции.
Реакция слабого основания с сильной кислотой имеет важное практическое значение в различных областях: от химической промышленности и лабораторных исследований до медицины и биологии. Учет данного взаимодействия позволяет контролировать показатели pH растворов, регулировать потенциал окислительно-восстановительных реакций, а также осуществлять множество других процессов, связанных с химическим равновесием и циклическими процессами в живых системах.